研究背景
阿爾茨海默病 (Alzheimer’s Disease, AD) 是一種隱匿、緩慢的神經(jīng)退行性疾病,是老年失智癥中最為常見的一種,據(jù)估計約占總失智病例的60%—80%[1]。短期記憶障礙是AD最常見的早期癥狀,其標(biāo)志性的病理特征是大腦神經(jīng)元外部淀粉樣斑塊沉積和神經(jīng)元內(nèi)部tau蛋白過度磷酸化導(dǎo)致的神經(jīng)原纖維纏結(jié)。隨病程的發(fā)展,患者逐漸喪失溝通能力、判斷力、方向感和生活的自理能力,最終失去語言功能、活動能力和吞咽能力[1]。
截至2015年,全世界共4600萬人患有AD。預(yù)計到2050年,全球患病人數(shù)將增加到1.3億,總醫(yī)療成本超1萬億美元,意味著僅AD醫(yī)療護(hù)理費用就可構(gòu)筑世界第18大經(jīng)濟體[2]。目前,我國現(xiàn)存AD患者已超過1000萬,并將保持較快增長。而預(yù)計到2030年,我國AD患者人數(shù)將達(dá)到約1600萬。我國已成為受AD影響程度最大的國家。因此,深入研究AD病因和病理機制,加速開發(fā)有效的AD預(yù)防和診療方案,已成為我國乃至全世界神經(jīng)科醫(yī)生和生物醫(yī)藥企業(yè)的一項重要任務(wù)。

圖 1. 阿爾茨海默病的全球影響[2]
AD的發(fā)病具隱匿性,在確診之前通常已經(jīng)經(jīng)歷了15-20年,甚至是更長時間的發(fā)展,這一階段被稱為AD的“前臨床期”[3]。隨著病程不斷發(fā)展,患者發(fā)生“輕度認(rèn)知障礙期” (Mild Cognitive Impairment, MCI) ,此時患者出現(xiàn)癥狀并進(jìn)行性加重,逐步發(fā)展到“輕度癡呆期”、“中度癡呆期”和“重度癡呆期” [4-7]。由于早期癥狀缺乏特異性,臨床上對AD患者很難做到早發(fā)現(xiàn)、早治療。AD最終會是致命的,多數(shù)患者確診后的預(yù)期壽命僅有4-8年。
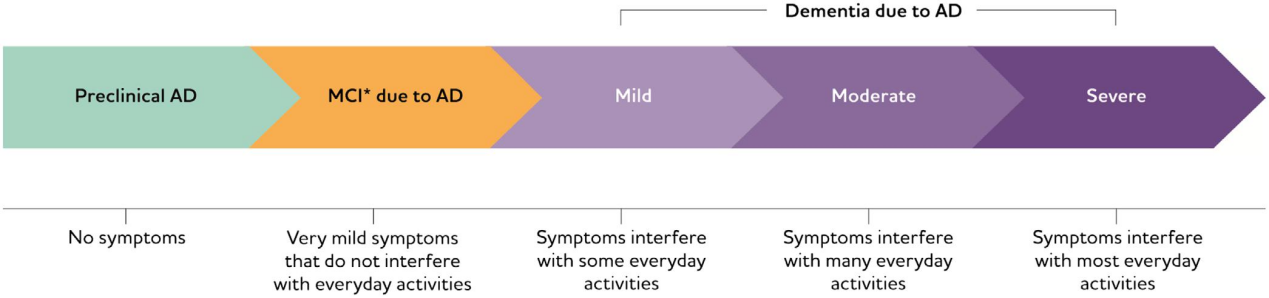
圖 2. 阿爾茨海默病的病程[1]
近年來,關(guān)于AD的研究日益深入,尤其是腦脊液(Cerebrospinal Fluid, CSF) 標(biāo)志物和影像學(xué)檢查手段的進(jìn)展,有效地提高了AD診斷的準(zhǔn)確性。國家衛(wèi)健委辦公廳發(fā)布了《阿爾茨海默病的診療規(guī)范 (2020年版) 》:建議對于疑似病患進(jìn)行一系列臨床評估,包含生物標(biāo)志物的檢查:腦脊液中β淀粉樣蛋白42 (Beta-Amyloid (1-42) , Aβ42) 水平下降,總Tau蛋白和磷酸化Tau蛋白 (phospho-Tau,p-Tau) 水平升高。


《阿爾茨海默病的診療規(guī)范 (2020年版) 》
標(biāo)志物分析
AD生物標(biāo)志物水平的改變常發(fā)生于前臨床期。除影像學(xué)檢查外,CSF生化分析也是AD篩查的常用手段[1]。相當(dāng)多AD患者CSF檢查可發(fā)現(xiàn)可溶性β-淀粉樣蛋白 (β-Amyloid, Aβ),特別是Aβ42的含量下降,而總Tau和p-Tau含量上升。CSF神經(jīng)絲輕鏈蛋白 (Neurofilament Light-chain, NF-L) 是一種新興的生物標(biāo)志物。NF-L在生理條件下分布于神經(jīng)細(xì)胞內(nèi)部。因此,釋放到CSF中NF-L的異常增加被認(rèn)為可以用來指示所造成神經(jīng)細(xì)胞變性[8,9]的原因。
由于血腦屏障的存在,大腦中的生物標(biāo)志物很難高效地進(jìn)入外周血液循環(huán),因此CSF樣本相比于血清樣本能為AD臨床診斷提供更多有價值的信息[10]。CSF中Aβ42含量下降是最早出現(xiàn)的改變,通常在患者出現(xiàn)顯著的認(rèn)知障礙前若干年即可檢出,而且具有很高的診斷靈敏度,因此在AD的早期篩查方面具有很大價值[11]。針對于AD標(biāo)志物的診斷試劑盒產(chǎn)品,已有多家企業(yè)拿到醫(yī)療注冊證,成為競相開發(fā)的熱點項目。
博奧森AD標(biāo)志物原料介紹
鑒于阿爾茨海病 (AD) 標(biāo)志物一般大部分的位點識別難,且不容易獲得臨床樣本和標(biāo)準(zhǔn)品,因此AD標(biāo)志物IVD原料的開發(fā)相對于常規(guī)IVD原料開發(fā)顯得更加的困難。二十年來,北京博奧森生物技術(shù)有限公司(Bioss)從未放棄對AD標(biāo)志物原料的研發(fā),步步優(yōu)化、不斷升級,現(xiàn)已推出成熟IVD配對抗體產(chǎn)品。
博奧森Aβ系列IVD抗體
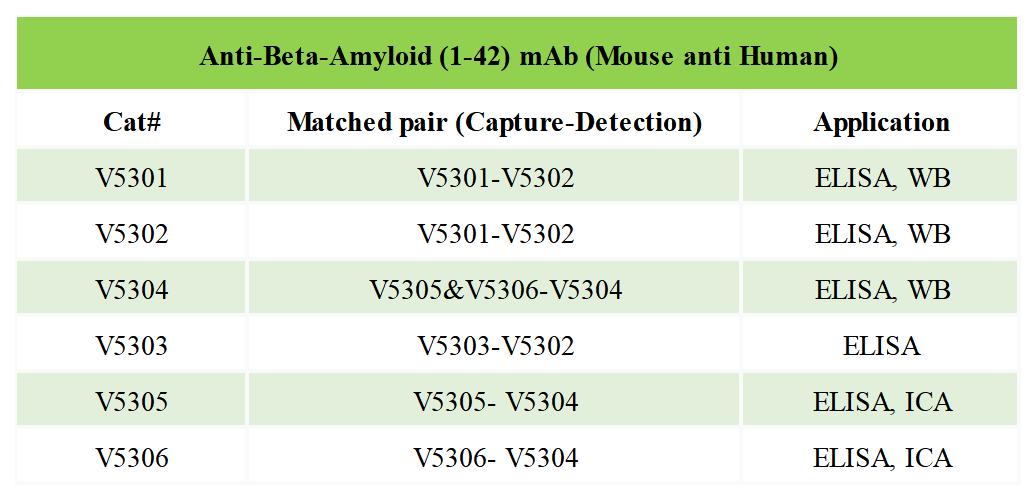
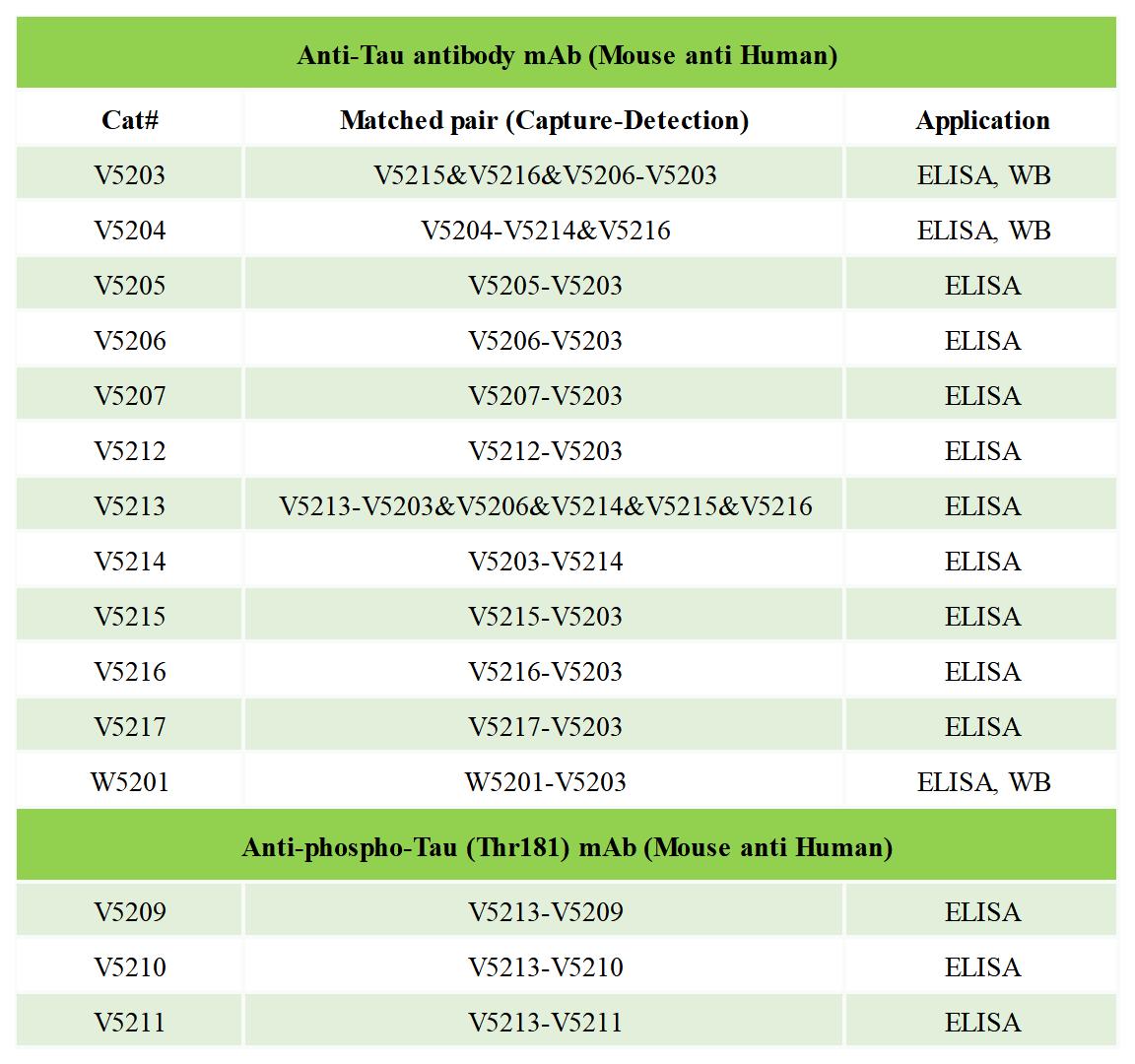
與Aβ42的下降相比,CSF中總Tau和p-Tau顯著上升發(fā)生在疾病進(jìn)程中較晚的時間點,與臨床可檢出的癡呆癥狀出現(xiàn)的時間非常接近[11]。因此,Tau蛋白相關(guān)的生物標(biāo)志物很難在AD早期篩查中發(fā)揮關(guān)鍵作用。檢測CSF中Tau的意義在于彌補單檢Aβ特異性差的問題。有許多Tau磷酸化位點有希望成為CSF的AD生物標(biāo)志物,研究較多的是蘇氨酸181磷酸化的tau (p-Tau181)。同時檢測CSF中Aβ42、總Tau和p-Tau181聯(lián)合判讀診斷法經(jīng)多年優(yōu)化后,敏感度和特異性均穩(wěn)定達(dá)到80%的閾值[12]。
博奧森Tau系列IVD抗體
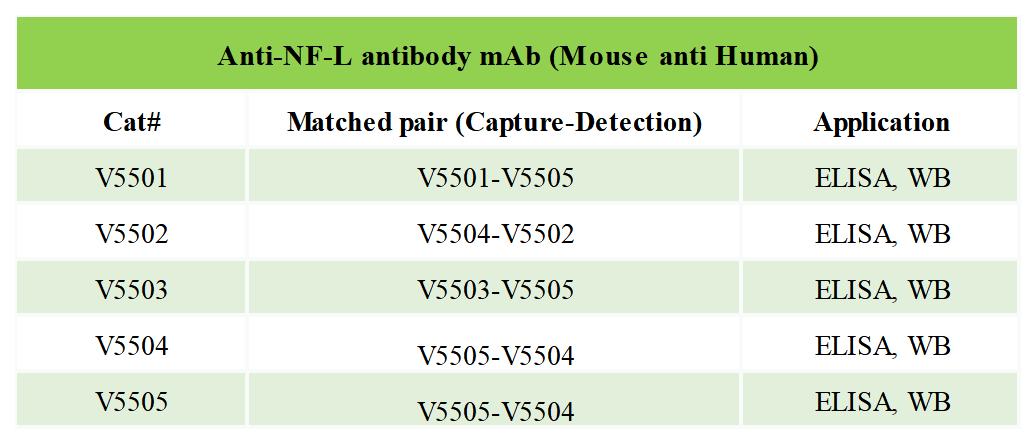
NF-L是神經(jīng)元完整性的另一個重要標(biāo)志物,它反映了腦白質(zhì)中軸突的損傷情況。因此,NF-L被認(rèn)為是包括AD在內(nèi),多種神經(jīng)退行性疾病的重要標(biāo)志物[13-15]。由于NF-L水平與神經(jīng)細(xì)胞的損傷情況高度相關(guān),CSF中NF-L含量與經(jīng)典指標(biāo)聯(lián)合應(yīng)用可進(jìn)一步提高診斷特異性和敏感度,并為AD病理發(fā)展階的劃分提供更多依據(jù)[16]。此外,NF-L是目前唯一一個被證明能直接從腦脊液轉(zhuǎn)移到血漿的標(biāo)志物[17]。因此,抽取CSF之前檢測患者的血清NF-L水平,很可能成為減少患者痛苦、提高醫(yī)療資源使用效率的更好方法。
博奧森NF-L系列IVD抗體
參考文獻(xiàn):
[1] Alzheimer’s Association. 2020 Alzheimer’s disease facts and figures [J]. Alzheimers Dement, 2020,16(3):391-460.
[2] Alzheimer’s Association. 2015 Alzheimer’s disease facts and figures [J]. Alzheimers Dement, 2015,11(3):332-384.
[3] Justin M. Long & David M. Holtzman. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies [J]. Cell, 2019, 179(10):1-28.
[4] Sperling RA, Aisen PS, Beckett LA, Bennett DA, Craft S, Fagan AM, et al. Toward defining the preclinical stages of Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s dis ease [J]. Alzheimers Dement, 2011;7(3):280-92.
[5] Albert MS, DeKosky ST, Dickson D, Dubois B, Feldman HH, Fox N, et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: Recommendations from the National Institute on Aging Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease [J]. Alzheimers Dement, 2011;7(3):270-9.
[6] McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR, Kawas CH, et al. The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s dis ease [J]. Alzheimers Dement, 2011;7(3):263-9. 77Flavanone accelerates Aβ aggregation and relieves cognitive impairment in AD model mice
[7] Jack CR, Albert MS, Knopman DS, Khann Mc, et al. Introduction to the recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease [J]. Alzheimers Dement, 2011;7(3):257-62
[8] Bridel C., van Wieringen W.N., Zetterberg H., et al. Diagnostic Value of Cerebrospinal Fluid Neurofilament Light Protein in Neurology: A Systematic Review and Meta-analysis [J]. JAMA Neurol,2019;17(7).
[9] Mielke M.M., Syrjanen J.A., Blennow, K., Zetterberg H., Vemuri P., et al. Plasma and CSF neurofilament light: Relation to longitudinal neuroimaging and cognitive measures [J]. Neurology, 2019;93:252-260.
[10] Bjerke M, Engelborghs S. Cerebrospinal Fluid Biomarkers for Early and Differential Alzheimer's Disease Diagnosis [J]. J Alzheimers Dis. 2018;62(3):1199-1209.
[11] Buchhave P, Minthon L, Zetterberg H., et al. Cerebrospinal fluid levels of betaamyloid 1-42, but not of tau, are fully changed already 5 to 10 years before the onset of Alzheimer dementia [J]. Arch Gen Psychiatry 69, 2012;98-106.
[12] Engel. S., De Vreese K., et al. Diagnostic performance of a CSF-biomarker panel in autopsy-confirmed dementia [J]. Neurobiol Aging 29, 2008;1143-1159.
[13] Wallin A, Ohrfelt A, Bjerke M.Characteristic clinical presentation and CSF biomarker pattern in CSVD [J]. J Neurol Sci 322, 2012;192-196.
[14] Rosenberg GA, Bjerke M, Wallin A. Multimodal markers of inflammation in the subcortical ischemic vascular disease type of vascular cognitive impairment. Stroke45, 2014;1531-1538.
[15] Wallin A, Kapaki E, Boban M, Engelborghs S., et al. Biochemical markers in vascular cognitive impairment associated with subcortical small vessel disease -A consensus report [J]. BMC Neurol 17, 2017;102.
[16] Somers C, Goossens J., et al. Selecting Abeta isoforms for an Alzheimer’s disease cerebrospinal fluid biomarker panel [J]. Biomark Med 11, 2014;169-178.
[17] Zetterberg H, Skillback T, Mattsson N., et al. Association of cerebrospinal fluid neurofilament light concentration with Alzheimer disease progression [J]. JAMA Neurol 73, 2016;60-67.