流式細胞術Flowcytometry
原理:流式細胞術(flowcytometry FCM)是對單個細胞或其他生物微粒進行快速定量分析和分選的一門技術。在分析或分選過程中,包繞在流動液體中處理過的單個細胞或微粒通過聚焦的光源,產生電信號,這些信號代表光散射、熒光等參數,以此測定出細胞或微粒的物理和化學性質,并可根據這些性質分選出高純度的細胞亞群,以對其進一步的培養或分析。
應用:流式細胞術的功能決定了其在免疫學基礎研究中的廣泛應用,目前在臨床上主要用于細胞表型分析、造血系腫瘤診斷和分型、移植前配型及與免疫有關疾病分析等。
(1)FCM在臨床醫學中應用
淋巴細胞亞群分析、血小板分析、網織紅細胞分析、白血病和淋巴瘤免疫分型、HLA-B27表型分析、PNH診斷、人類同種異體器官移植中的應用、艾滋病的診斷與治療。
(2)FCM在基礎研究中的應用
淋巴細胞功能、樹突狀細胞研究、造血干/祖細胞研究、細胞周期分析、細胞凋亡分析、總蛋白測定、細胞因子測定、細胞膜電位測定、胞內鈣離子測定、細胞內pH測定、細胞內活性氧檢測、蛋白質磷酸化檢測、flow-FISH法測定端粒長度。
作為應用流式細胞術進行檢測的技術平臺,現代流式細胞儀產生于上世紀六七十年代。經過近四十年的發展和完善,今天的流式細胞儀已經十分成熟,并被廣泛的運用于從基礎研究到臨床實踐的各個方面,涵蓋了細胞生物學、免疫學、血液學、腫瘤學、藥理學、遺傳學及臨床檢驗等領域,在各學科中發揮著重要的作用。
一、流式細胞抗原染色方法
細胞表面抗原標記:細胞在各自正常分化成熟的不同階段以及活化過程中,其細胞膜表面均可表達供鑒別的特殊結構,即表面標志。流式細胞術在細胞表面分子的檢測與分析主要應用于免疫細胞及其亞群的檢測與功能分析;血液系統細胞表面標志的研究;細胞群體及細胞表面標志變化的檢測;細胞表面標志構成性質分析。
細胞內抗原標記細胞內或細胞核內染色結合流式細胞術分析確定某些細胞內細胞因子或蛋白表達水平。分析細胞內或細胞核內抗原的關鍵在于熒光標記的單克隆抗體能自由進入細胞內或細胞核內,且不能破壞細胞形態的完整性和保持細胞內靶抗原不變。因此細胞內或核內染色的關鍵在于細胞固定和胞膜或核膜穿透。
A、表面抗原直接標記
1、將消化下來的細胞用1 X PBS洗兩遍,然后用0.5 mL 0.5%BSA的 1 X PBS重懸。
2、加入等量預熱的4%多聚甲醛固定細胞,37℃,10分鐘。(可選步驟)
3、用0.5%BSA的1 X PBS洗兩遍。
4、3%BSA封閉。
5、樣本標記:100μl 0.5%BSA的 1 X PBS內細胞量為0.5-1X106個
a)不標記細胞樣本
b)同型對照
c)標記一抗
6、以抗體說明書上的比例加入抗體,冰上孵育30分鐘。
7、用0.5%BSA的 1 X PBS洗兩遍。
8、加入500 μl 1 X PBS上機檢測。
B、表面抗原間接標記
1、將消化下來的細胞用1 X PBS洗兩遍,然后用0.5 mL 0.5%BSA的 1 X PBS重懸。
2、加入等量預熱的4%多聚甲醛固定細胞,37℃,10分鐘。(可選步驟)
3、用0.5%BSA的 1 X PBS洗兩遍。
4、樣本標記:100μl 0.5%BSA的 1 X PBS內細胞量為0.5-1X106個。
a)不標記細胞樣本
b)單獨二抗
c)同型對照+二抗
d)一抗+二抗
5、以抗體說明書上的比例加入抗體,冰上孵育30分鐘。
6、用0.5%BSA的 1 X PBS洗兩遍。
7、0.5%BSA的 1 X PBS重懸細胞后加入等體積10%山羊血清,室溫孵育15分鐘。
8、加入熒光標記二抗,放置冰上,避光條件下孵育30分鐘。
9、用0.5%BSA的1 X PBS洗兩遍。
10、加入500μl 1 X PBS上機檢測。
C、胞內抗體直接標記
1、將消化下來的細胞用1 X PBS洗兩遍,然后用0.5 mL 0.5%BSA的 1 X PBS重懸。
2、加入等量37℃預熱的4%多聚甲醛固定細胞,37℃孵育10分鐘。
3、用0.5%BSA的 1 X PBS洗兩遍并用1ml 90%的冰甲醇重懸細胞,放置冰上30分鐘。
4、用0.5%BSA的 1 X PBS洗兩遍。
5、3%BSA封閉。
6、樣本標記:100μl 0.5%BSA的 1 X PBS內細胞量為0.5-1X106個。
a)不標記細胞樣本
b)同型對照
c)一抗
7、以抗體說明書上的比例加入抗體,冰上孵育30分鐘。
8、用0.5%BSA的 1 X PBS洗兩遍。
9、加入500μl 1 X PBS上機檢測。
D、胞內抗體間接標記
1、將消化下來的細胞用1 X PBS洗兩遍,然后用0.5 mL 0.5%BSA的 1 X PBS重懸。
2、加入等量預熱的4%多聚甲醛固定細胞,37℃孵育10分鐘。
3、用0.5%BSA的 1 X PBS洗兩遍并用1ml 90%的冰甲醇重懸細胞,放置冰上30分鐘。
4、用0.5%BSA的 1 X PBS洗兩遍。
5、樣本標記:100μl 0.5%BSA的 1 X PBS內細胞量為5X105-1X106個。
a)不標記細胞樣本
b)單獨二抗
c)同型對照+二抗
d)一抗+二抗
6、以抗體說明書上的比例加入抗體,冰上孵育30分鐘。
7、用0.5%BSA的 1 X PBS洗兩遍。
8、0.5%BSA的 1 X PBS重懸細胞后加入等體積10%山羊血清,室溫孵育15分鐘。
9、加入熒光標記二抗,放置冰上,避光條件下孵育30分鐘。
10、用0.5%BSA的1 X PBS洗兩遍。
11、加入500μl 1 X PBS上機檢測。
直接免疫熒光標記法 本方法操作簡便,結果準確,易于分析,適用于同一細胞群多參數同時測定。雖然直標抗體試劑成本較高,但減少了間接標記法中較強的非特異熒光的干擾,因此更適用于臨床標本的檢測。
間接免疫熒光標記法 本方法費用較低,二抗應用廣泛,多用于科研標本的檢測。但由于二抗一般為多克隆抗體,特異性較差,非特異性熒光背景較強,易影響實驗結果。所以標本制備時應加入陰性或陽性對照。另外,由于間標法步驟較多,增加了細胞的丟失,不適用測定細胞數較少的標本。
二、數據采集與分析
數據的顯示通常可分為一維單參數直方圖(histogramplot)、二維點圖(dotplot)、二維等高圖(contour)和假三維圖(pseudo3D)等。最常用的是單參數直方圖和二維點圖。
1.單參數直方圖
用來進行定性分析和定量分析。橫坐標表示熒光信號或散射光信號強度的相對值,其單位用“道數”(channel)表示,橫坐標可以是線性的,也可以是對數的。縱坐標通常代表細胞出現的頻率或相對細胞數。
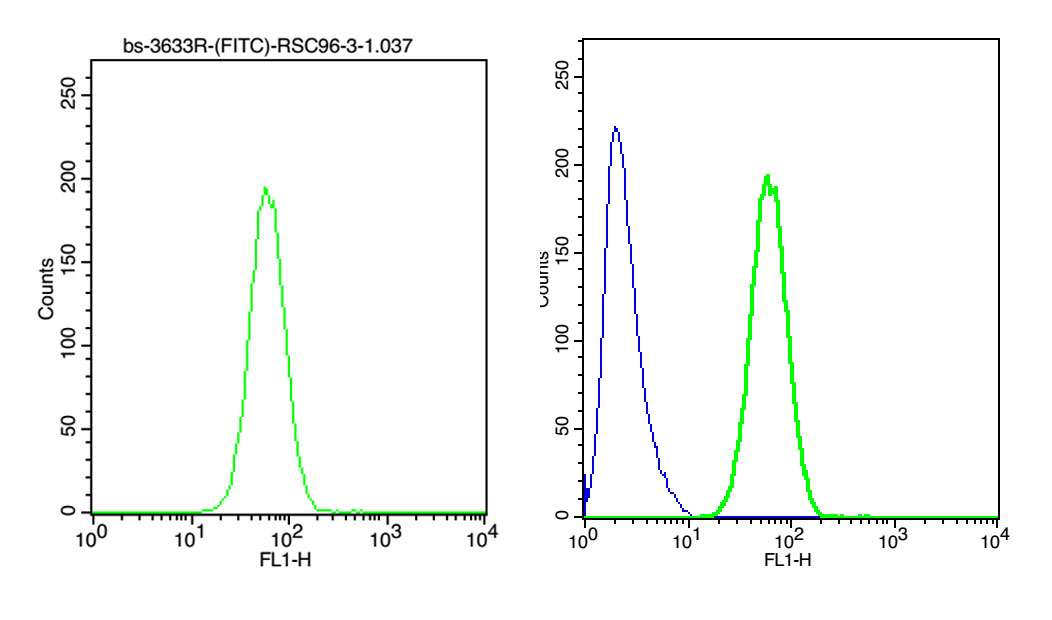
單參數直方圖
2. 二維點圖
當需要研究兩個或更多測量參數之間的關系時,可采用二維點圖。二維點圖有兩種形式,橫坐標表示前向散射光(FSC),反映細胞的大小;縱坐標表示側向散射光,反映細胞內顆粒的大小和多少。坐標圖上每一點同時表示具有相應坐標值的細胞存在。
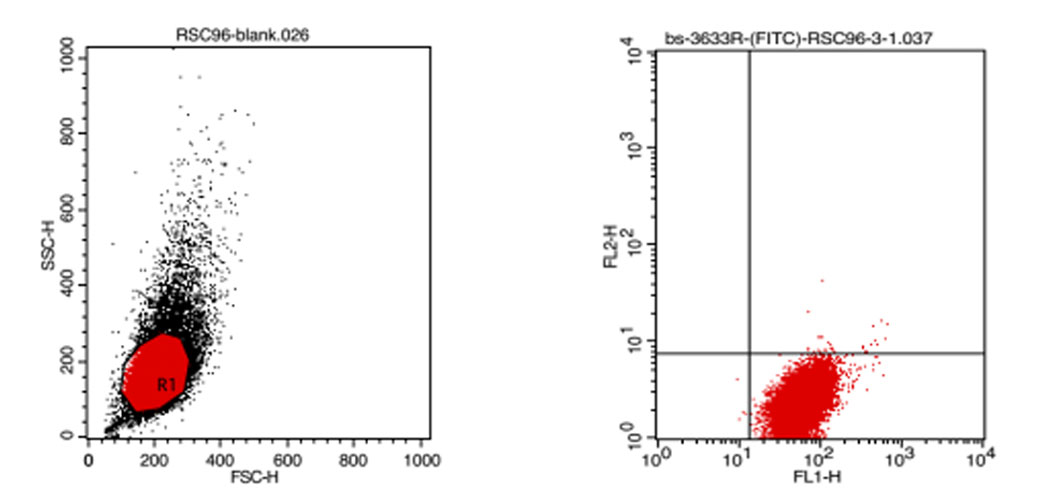
二維點囤的細胞群框定 熒光單染色二維點圖
三、流式抗體選擇標準
1. 滿足抗體選擇的基本條件
靶蛋白特異性:確定目的細胞的特異性表面標記或者胞內標記,知道您要檢測什么。
種屬:嚴格按照待測樣本種屬選擇抗體來源,流式抗體基本無法進行種屬間交叉反應。
應用領域:可用于流式實驗,說明書中明確標注經FC實驗測試,最好有實驗數據圖和用量說明。
抗體克隆號:一般選擇參考文獻上提到的克隆;同一抗體多個克隆號的情況下,可以選擇熒光標記種類最多的那個克隆。
2. 確定流式細胞儀的參數配置
在設計流式方案前,先確定需要使用流式細胞儀檢測的型號,對該儀器的參數配置要了解以下幾個方面信息:
激光器:常見的流式細胞儀有488nm和635nm/633nm兩個激光器,但有些機器在購買時因某些原因,只裝了一個488nm激光器,所以需要注意型號相同的機器也未必激光配置相同。
濾光片:也就是有幾個檢測通道,這決定了你最多可以同時檢測幾個指標。
儀器的具體型號:有助于再次確定檢測通道。因為同一個熒光在不同的流式細胞儀上檢測,有時候檢測通道也是不一樣的。
3. 熒光的選擇
選擇直標還是間標:待測抗原表達高的盡量選擇直標抗體,待測抗原表達豐度低的要考慮選間標生物素標記標抗體。
熒光強弱:熒光本身有強弱之分,可視抗原表達強弱及分群情況選擇合適的熒光。如抗原表達弱或分群不明顯的建議選擇強熒光例如:PE、APC;反之,抗原表達強或分群明顯的建議選擇最常用的弱熒光例如FITC即可(常用熒光強弱排序程度為:PE>APC>PE-cy5/Cy5>PerCP/PerCP-Cy5.5/Cy5.5>FITC。
4. 多色熒光搭配的原則
多色分析方案中熒光抗體的選擇和搭配,會受到很多因素的制約:
檢測通道不能沖突:每個檢測通道只能選擇1種熒光素,各通道之間的熒光素可以隨意搭配(如FL1選擇了FITC標記的抗體,就不能再選擇Alexa Fluor488標記的抗體;而同組實驗的其余抗體選擇PE或者APC標記,都是可以隨意組合的);
熒光強弱:所選各種熒光素光譜的重疊應當盡量減少,否則將會導致較大的補償。最常用的4色熒光搭配是:FITC、PE、PerCP/PerCP-Cy5.5、APC;
5. 同型對照抗體的選擇
同型對照(Isotype Control),用于消除由于抗體非特異性結合到細胞表面而產生的背景染色,是真正意義上的流式陰性對照,流式細胞實驗不可或缺的一項。同型對照是使用與一抗相同種屬來源、相同亞型及亞鏈、相同熒光標記的免疫球蛋白,也要求使用相同劑量。
純化級別抗體:如果是純化的一抗加熒光標記的二抗,那么應該選擇與一抗相對應的同型對照抗體(如樣品管為:純化的CD3+PE標記的二抗+樣本;則對照管為:純化的同型對照+ PE標記的二抗+樣本)。
四、流式檢測樣品的制備
提示
1、流式細胞儀檢測需要將細胞制備成單細胞懸液。
2、避免細胞成團,以免堵塞流式細胞儀。
3、實體組織制備單細胞懸液需要物理方法分離或酶消化法進行,具體組織的方法,依照經驗來進行。
方案A: 培養細胞的制備
實驗材料:0.25%胰,15ml或50ml的離心管。
實驗流程:
1、如果是懸浮細胞,則小心將細胞移入離心管中,進行計數和活力分析。進行步驟3。
2、如果是貼壁細胞,建議使用0.25%的胰酶消化細胞,制備成單細胞懸液后置于離心管中計數和活力分析。
3、200g 離心5min。棄去上清,應用適量的流式孵育緩沖液重懸細胞,調整細胞濃度為1×107/ml。
方案B: 組織細胞制備。
實驗材料與試劑:剪刀和鑷子,載玻片, 60×15mm的組織培養皿;細胞過濾器(尼龍網過濾),0.01MPBS。
實驗流程:
1、獲取組織剪碎或切碎組織為2~4mm碎塊,用1XPBS沖洗一遍,盡量多的去除組織內血塊。
2、將剪碎的組織放在載玻片磨砂邊,滴加兩滴1XPBS, 另取一個磨砂邊的載玻片進行研磨細胞至粘稠無顆粒物,過濾除去細胞碎片。
3、加PBS 5ml,200g離心5min,棄去上清。重復洗滌一次,計數和活力分析。
4、300g 離心5min,棄去上清,應用適量的流式孵育緩沖液重懸細胞,調整細胞濃度為1×107/ml。
五、常見問題與解答
1. 高熒光強度背景
(1)熒光標記的抗體濃度應該合適,如果濃度過高,背景會因為非特異性相互作用的增加而增加。
(2)在使用第一抗體之前,將樣品與過量的蛋白一起培育,如小牛血清蛋白(BSA),脫脂干奶酪,或來自于同一寄主的正常血清作為標記的第二抗體。這個步驟通過阻斷第一抗體和細胞表面或胞內結構的非特異性的交互作用來降低背景。
(3)在使用第一抗體之后,將樣品與5%至10%的來自于同一寄主的正常血清和作為標記的第二抗體一起培育。這個步驟會減少不必要的第二抗體與第一抗體、細胞表面或胞內結構之間的交互作用。
2. 細胞染色陽性但很弱
(1) 抗細胞因子抗體濃度不對或者熒光染料選擇不合適,增加抗體濃度,標本表面抗原表達量低,應該選擇熒光強度高的熒光染料,如PE,APC等。 (2)通透后細胞在胞內染色前未洗, 按操作程序通透后洗細胞再胞內染色。(3)抗體與固定后的胞內抗原親和力低,需提高抗體濃度。
3、嚴重的細胞損失
(1)洗滌離心步驟丟失細胞,固定后細胞密度低于活細胞,需用高轉速離心,固定通透的細胞離心500g 。(2)加樣步驟丟失細胞或棄上清帶走細胞,應小心吸樣。
六、注意事項
1. 標本處理:(1)全血實驗 避免使用絡合鈣的抗凝劑,如ACD與EDTA,因為它們會限制鈣依賴性激活過程,推薦用肝素鈉。此外LPS,一種常見的生物試劑污染物,是強細胞激活劑,可能會混淆試驗結果。血樣在8小時內分析,超過8小時會導致活性的損失,一般細胞因子陽性細胞會減少5%。如不能在8小時之內檢測,應將真空采血管水平室溫放置。(2)組織樣本制備 取組織時去除組織內凝固的血塊。(3)固定,穿膜的試劑PH一定要正確。
2. 選擇合適的對照:為保證結合的真實和可靠性,至少熒光設置同型對照:用于消除由于抗體非特異性結合到細胞表面而產生的背景染色;陰性對照(Isotype Control):非特異熒光的強弱取決于抗體濃度、單克隆熒光抗體特異性和純度,應與試驗管抗體相對應。在多色分析時,同型對照應與其它抗體同時使用,以避免補償造成的誤差。
3. 熒光素的選擇:檢測相對低表達細胞因子如IL-4時,應選用PE或APC標記;單檢測某一細胞因子時最好也選用PE或APC標記;同時檢測多種細胞因子時,弱表達的應選用PE或APC,FITC標記最好用于高表達細胞因子如IFN-γ。
4.采用直接與間接免疫熒光混合染色法時,原則上先進行間接標記,再進行直接標記。間接標記為細胞內染色時,應該考慮固定或透膜劑對直接標記抗體與靶目標的親和力或靶目標的抗原性的變化等影響,若影響大,則應該先標記直接抗體。
流式檢測所需溶液和試劑
1. 1X磷酸鹽緩沖液(PBS):將8 g氯化鈉(NaCl),0.2 g氯化鉀(KCl),1.44 g磷酸氫二鈉(Na2HPO4),0.24 g磷酸二氫鉀(KH2PO4)溶解在800 ml蒸餾水(dH2O)中。用鹽酸調節pH到7.4,定容至1升。室溫保存。
2. 4%多聚甲醛溶液(無甲醇的): 100ml雙蒸水中加入8g多聚甲醛然后在水浴鍋中加熱至50-60℃,加入幾滴1mol/L的NaOH邊加邊攪拌直至全部溶解,溶解后置于冰水中冷卻至室溫,加入100ml的2倍的PBS。調節PH為7.4。
3. 孵育緩沖液:將0.5 g牛血清白蛋白(bovine serum albumin,BSA)溶解在100 ml的1 X PBS中。保存在4℃C。